近日,广医-广州生物院联合生科院张文亮教授团队在国际肿瘤学权威期刊Journal of Experimental & Clinical Cancer Research(《实验临床癌症研究杂志》)发表题为Non-canonical activation of MAPK signaling by the lncRNA ASH1L-AS1-encoded microprotein APPLE through inhibition of PP1/PP2A-mediated ERK1/2 dephosphorylation in hepatocellular carcinoma的研究论文。该研究报道lncRNA ASH1L-AS1在肝癌中通过编码一段90个氨基酸的微蛋白APPLE,直接干预ERK1/2去磷酸化过程,从而以非经典方式持续活化MAPK信号通路,显著促进HCC的进展。

肝细胞癌(HCC)是全球范围内发病率和致死率最高的实体肿瘤之一,尽管近年来,肝癌在早期筛查和靶向治疗方面取得一定进展,但HCC的高异质性及靶向治疗反应率低等问题仍严重制约其临床疗效。丝裂原活化蛋白激酶/细胞外信号调节激酶信号通路(MAPK/ERK)是推动HCC发生发展的关键通路之一,然而与其他癌种不同,HCC中经典RAS/RAF/MEK通路突变率较低,提示其激活机制可能依赖于尚未充分认识的非经典调控途径。长链非编码RNA(lncRNA)及其编码的微蛋白近年来逐渐成为癌症研究的新热点,其在肿瘤信号转导中的功能尚待深入挖掘。
首先,研究团队通过生物信息分析,系统筛选出696条具有翻译潜能的lncRNA。其中,ASH1L-AS1因其在多组学中呈现出较强的翻译证据、显著关联肿瘤恶性程度与免疫抑制表型,并与雌激素信号密切相关而被重点关注。
研究发现,ASH1L-AS1编码微蛋白APPLE在HCC细胞及肿瘤组织中稳定上调,且高表达与不良预后密切相关。功能实验显示,APPLE促进HCC细胞增殖、迁移与侵袭,并推动异种移植瘤生长;其敲低或ERK1/2抑制可显著逆转相关表型,提示其为HCC发展的重要驱动因子。
机制研究进一步揭示了APPLE作用的独特之处。该微蛋白可同时结合磷酸化ERK1/2及其去磷酸化酶PP1/PP2A,从而抑制ERK1/2去磷酸化过程,维持MAPK信号持续活化。与传统的RAS-RAF-MEK级联激活方式不同,这一机制揭示了HCC中MAPK信号异常活化的非经典路径,为MAPK信号通路研究提供了新的理论框架。
此外,转录因子E2F1可结合ASH1L-AS1启动子区并增强其表达,形成E2F1–ASH1L-AS1/APPLE–ERK1/2的正反馈调控轴,进一步放大MAPK信号活性。随后,药物敏感性分析预测出220种可能靶向该信号轴依赖型HCC亚型的治疗组合,为精准治疗提供了潜在策略。
此研究在理论上具有突破性:一方面推动了对lncRNA翻译潜能及其编码微蛋白功能的系统认知,另一方面揭示了通过调控磷酸酶活性维持MAPK信号的新机制,首次构建了lncRNA-编码微蛋白调控MAPK磷酸化平衡的非经典通路,为HCC靶向治疗提供了新思路和潜在靶点。
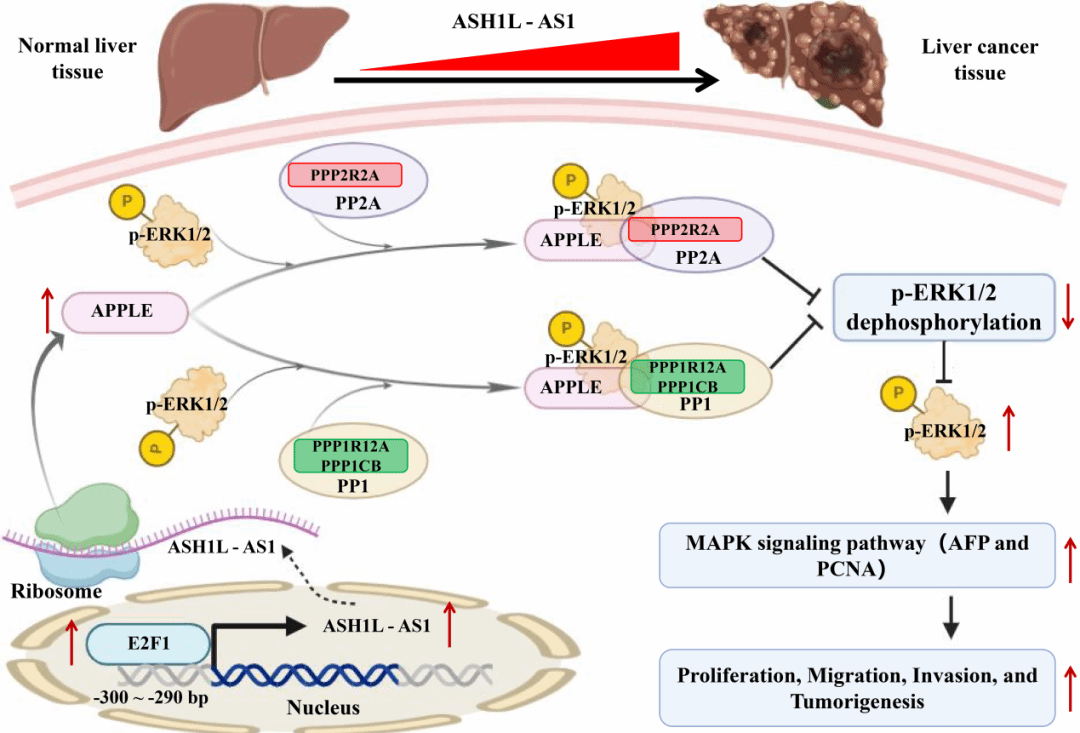
分子机制示意图
项目由广医-广州生物院联合生科院牵头,联合广州医科大学附属第一医院、南方医科大学南方医院、香港大学深圳医院、中山大学附属第一医院共同完成。广医-广州生物院联合生科院赵蕾博士后、司珂博士后,南方医科大学罗神坚副研究员为论文并列第一作者,广医-广州生物院联合生科院张文亮教授为通讯作者。研究团队特别感谢广州医科大学附属第三医院晏光荣教授和中山大学中山医学院王海河教授为项目提出的宝贵指导和建议。研究工作得到了广州医科大学高层次人才启动基金、国家自然科学基金(32100513)、广州市科技计划项目(2024A04J3341)、粤港澳细胞命运调控与疾病联合实验室(2022LSYS008)等项目的资助。