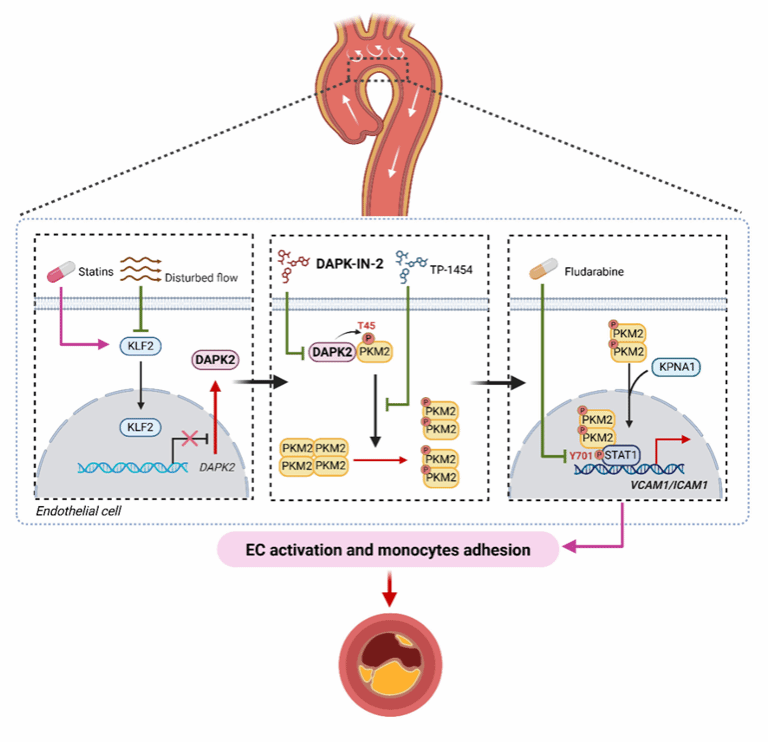
动脉粥样硬化具有显著的局灶性特征,血管分叉与弯曲处的湍流(D-flow)及其产生的振荡剪切力(OSS)是诱发内皮炎症和斑块形成的关键因素。尽管多条机械敏感通路已被报道,可用于干预的核心靶点仍十分有限。
1月30日,基础医学院徐益鸣教授课题组在心血管顶级期刊Circulation发表研究论文,首次鉴定死亡相关蛋白激酶2(DAPK2)为高度机械敏感的内皮激酶,并系统阐明其在湍流诱导的内皮炎症与动脉粥样硬化中的关键作用及分子机制。

研究通过多组学分析发现,DAPK2是湍流区域上调最显著的内皮基因,并在体外OSS刺激、体内主动脉弓小弯及人颈动脉病变中均显著升高。功能研究显示,DAPK2促进黏附分子VCAM‑1/ICAM‑1表达和单核细胞黏附,其促炎效应依赖激酶活性。内皮特异性Dapk2缺失显著抑制湍流诱导的内皮激活,并在多种动脉粥样硬化模型中有效减轻斑块形成。
机制上,DAPK2直接结合并磷酸化PKM2的Thr45位点,促进其从四聚体向二聚体/单体构象转变及核转位。核内PKM2进一步增强STAT1活化,驱动黏附分子转录,从而放大内皮炎症反应。靶向DAPK2的小分子抑制剂DAPK‑IN‑2在细胞与动物模型中均表现出良好的抗动脉粥样硬化潜力。
该研究揭示了“D-flow-DAPK2-PKM2T45-STAT1”这一全新的机械敏感炎症轴,确立DAPK2作为连接血流力学信号与内皮炎症反应的关键调控节点,为动脉粥样硬化的精准防治提供了新的理论基础和潜在药物靶点。
基础医学院博士研究生郭帅、博士后徐龙,药学院讲师陈亦欣,基础医学院硕士研究生赵袁为本文共同第一作者。徐益鸣教授为本文唯一通讯作者。广州医科大学为本文第一作者和通讯作者单位。该研究得到贝勒医学院霍玉庆教授、爱丁堡大学Andrew Baker教授、香港城市大学王力教授、北京大学周源教授、浙江大学骆江云教授、广州中医药大学鲁路教授、兰州大学张文华教授和广医二院艾文佳教授的支持。
原文链接:https://doi.org/10.1161/CIRCULATIONAHA.125.075951