半胱氨酰白三烯受体2(CysLT2R)是炎症、哮喘等疾病的重要靶点,但其激活机制不明,制约了药物研发。12月16日,广医-广州生物院联合生科院刘恒教授团队与中国科学院深圳先进技术研究院王崇元研究员团队在Nature Communications上在线发表题为“Molecular insights into ago-allosteric modulation at Cysteinyl leukotriene receptor 2”的研究论文。该研究解析了人源CysLT2R与内源性配体LTC4/LTD4及Gq蛋白结合的冷冻电镜结构,发现配体并非结合于传统胞外口袋,而是结合于跨膜区膜内侧的别构口袋,并揭示了其作为“别构-正向协同激动剂(ago-PAM)”的非经典激活机制。这一突破性发现为针对CysLT2R的药物研发提供了全新的结构基础和靶点思路。

CysLT2R属于GPCR家族,其内源性配体CysLTs(LTC4、LTD4和LTE4)在多种疾病中起关键作用。尽管CysLT1R拮抗剂(如孟鲁司特)已用于哮喘治疗,但CysLT2R靶向药物开发因缺乏高分辨率结构而停滞。研究团队通过冷冻电镜发现,LTC4和LTD4结合于由TM3、TM4、TM5和ICL2围成的别构口袋,而非此前推测的胞外正构位点,彻底修正了对该受体配体结合模式的认知。
功能实验表明,CysLTs不仅能直接激活CysLT2R,还可显著增强另一于近期鉴定的内源性正构位点激动剂神经酰胺的结合。证实其具有“ago-PAM”的协同作用特性。这一发现解释了为何仅靶向正构位点的拮抗剂在临床中难以完全抑制受体活性,为理解受体在病理状态下的复杂调控提供了关键线索。
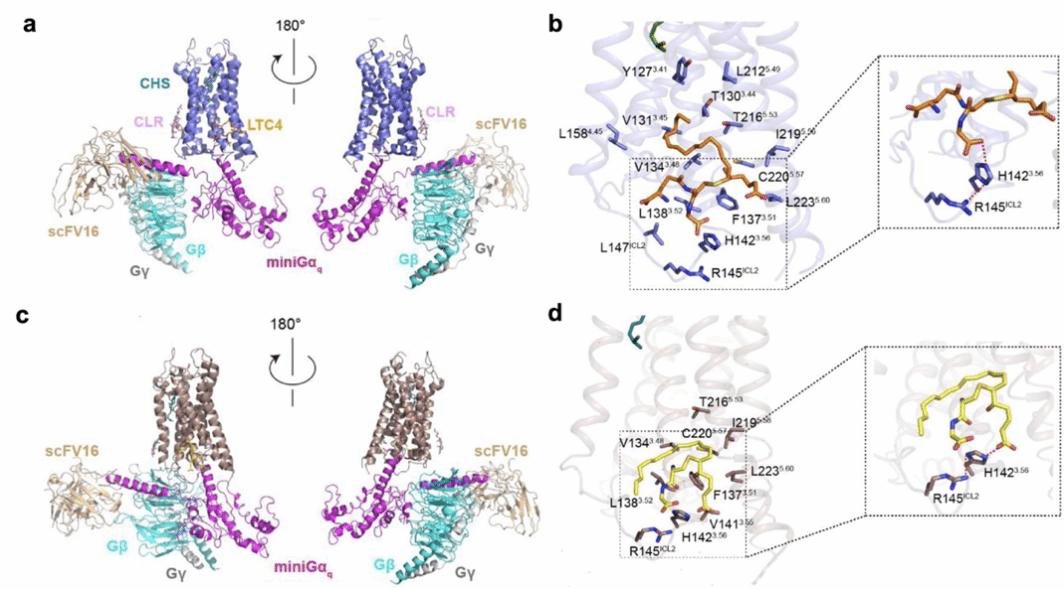
CysLT2R信号转导复合物的整体结构与配体结合口袋
结构对比显示,配体结合诱导ICL2构象上升,促使TM5向TM6靠拢,进而推动TM6外移,最终完成Gq蛋白的招募与激活。该信号传递直接从胞内侧发起,无需经过传统GPCR所依赖的胞外结构域构象重排,为GPCR别构调控机制提供了新范例。
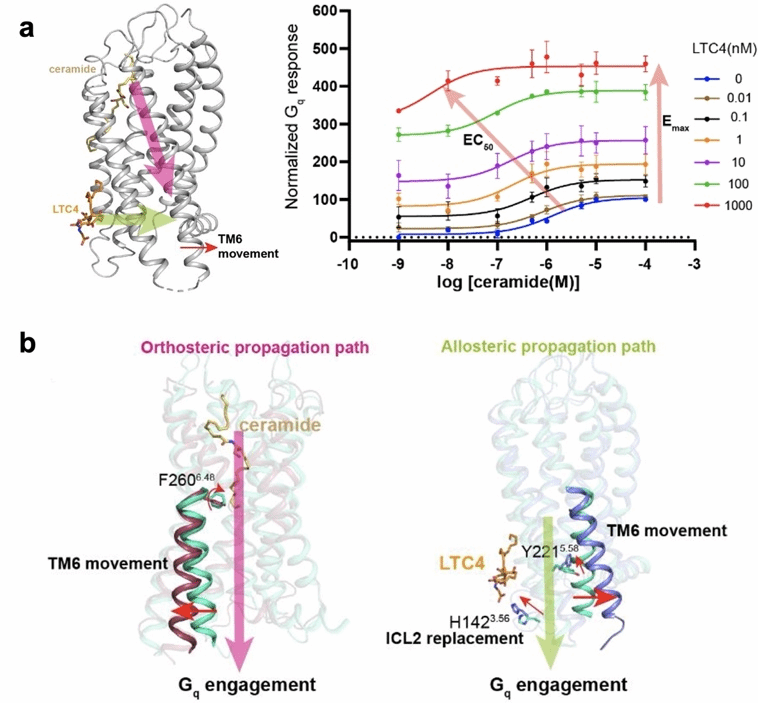
CysLT2R的别构激活机制
该研究不仅解决了领域内长期存在的关键科学问题,也为未来药物研发带来多重启示:靶向新发现的“ICL2别构口袋”可设计更强效、精准的抑制剂;开发能同时占据正构与别构口袋的“双位点配体”,有望获得更高选择性与活性;此外,多配体协同调控机制的揭示有助于在临床中实现更个性化的治疗策略。
广医-广州生物院联合生科院博士后李牧,广州医科大学科研实验中心鲍小玲博士,中国科学院深圳先进技术研究院博士后陈万标,广医-广州生物院联合生科院博士研究生郭宇升、硕士研究生毛小敏、博士研究生肖淼芳为本文的共同第一作者。广医-广州生物院联合生科院刘恒教授,中国科学院深圳先进技术研究院王崇元研究员为本文的共同通讯作者。广医-广州生物院联合生科院硕士研究生刘思琪、博士研究生常添彩和博士后钟福梅,深圳市龙华区中心医院赵力敏教授、李佳娓博士也为该项研究做出了重要的贡献。
原文链接:https://doi.org/10.1038/s41467-025-67630-7