近日,广州医科大学唐小平教授、孙宝清教授团队,与自贡市第一人民医院、遵义医科大学第五附属医院及美国费城儿童医院等单位合作,在新冠Omicron变异株感染致肺部损伤机制研究中取得重要突破。相关研究"VCL/ICAM-1 pathway is associated with lung inflammatory damage in SARS-CoV-2 Omicron infection",发表在国际权威期刊Nature Communications。
Omicron变异株与Ancestral原始毒株在传播能力及免疫逃逸方面存在显著异质性。相较于原始毒株,其传播更快,受感染群体更广。而感染者却常出现临床指标与疾病表现不一致的情况。基于这种“高传染性—低典型性”特征,应用痕量多组学整合分析,可从高通量、多维度层面精准解析Omicron变异株的肺损伤及气血屏障破坏机制,是揭示其致病机理的最优技术路径。
本研究共纳入60例Omicron变异株感染者、20例原始毒株感染者及35例健康对照者。分别构建发现队列与验证队列。通过蛋白质组学、蛋白修饰组学与代谢组学联合测序,系统筛选并鉴定出与肺实质渗出密切相关的特征性蛋白通路—VCL(钙粘附蛋白)/ICAM-1(细胞间黏附分子-1)。

分组队列,不同组别蛋白序列差异性分析
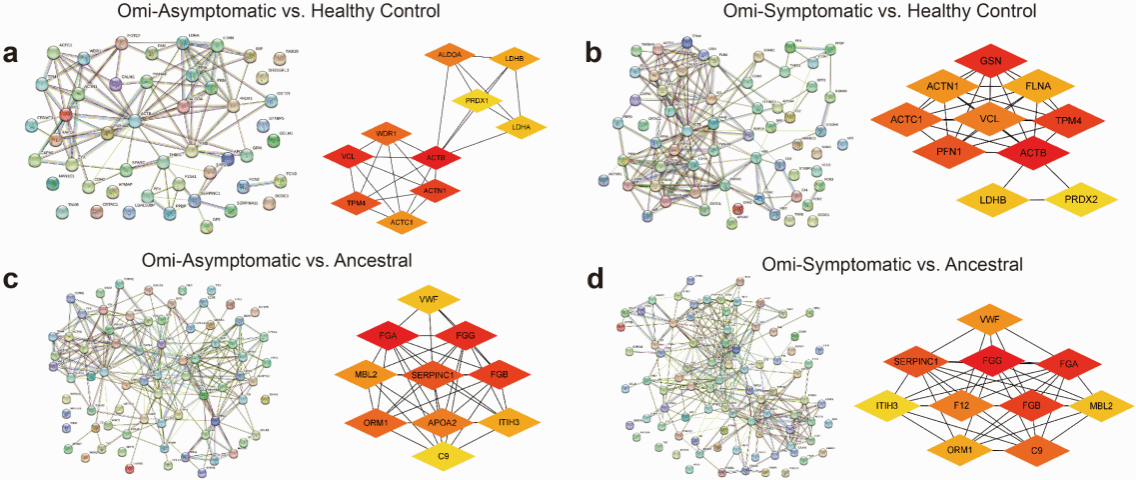
Omicron与Ancestral患者血浆蛋白互作网络
研究发现VCL/ICAM-1的激活可重塑细胞骨架,促使炎症细胞浸润和气血屏障通透性增加,最终引发不同程度的肺实质渗出。这可能是导致患者呼吸困难、咳嗽等呼吸相关症状的关键因素。
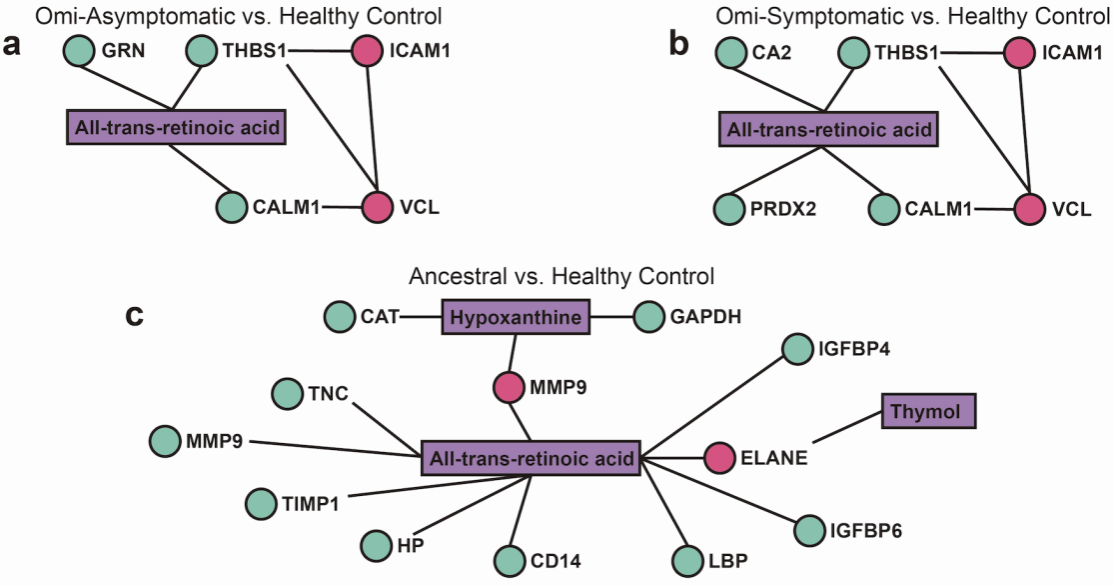
蛋白-代谢互作网络
鉴于该通路具有黏附调控功能,故采用N糖基化修饰分析探索黏附位点,进一步印证了该型蛋白的功能特性,提示对应蛋白的糖基化修饰改变可能是细胞黏附与炎症反应的始动因素。
此外,代谢组学所揭示的TCA循环与糖酵解代谢紊乱,意味着感染个体存在能量稳态失衡,这是促进炎症诱导与局部缺氧的微环境因素。可能与VCL/ICAM-1通路异常互为因果。

代谢组学分析
基于大鼠肺损伤模型,联合MicroCT与透射电镜技术可视化气血屏障结构,并通过抗VCL蛋白结合性抗体靶向阻断VCL的结合功能,有效抑制肺渗出、促进肺泡复张并加速渗出液吸收。

气血屏障损伤及抗VCL蛋白结合性抗体干预后肺组织结构修复
研究首次明确了VCL作为SARS-CoV-2肺损伤干预潜在靶点的可行性,为新冠肺炎及未来病毒性肺损伤治疗提供了新思路。

VCL/ICAM-1通路与Omicron变异株感染中的肺部炎症损伤相关
本研究由广州医科大学附属第一医院薛明汕博士、林志威博士,自贡市第一人民医院温友利教授共同担任第一作者;广州医科大学唐小平教授、孙宝清教授、遵义医科大学第五附属医院王红嫚教授及自贡市第一人民医院邓志平教授共同担任通讯作者。项目得到了国家自然科学基金、广东省自然基金及广东省钟南山医学基金会的资助。
论文链接:https://www.nature.com/articles/s41467-025-59145-y